Implementación rápida de diseños de citómetros de flujo mediante módulos de adquisición de datos de alta precisión
Colaboración de Editores de DigiKey de América del Norte
2022-04-21
La citometría de flujo es ampliamente utilizada por los clínicos y diagnosticadores para analizar las características de las células. Una célula a la vez, evalúan ópticamente los niveles de proteínas, la salud de la sangre, la granularidad y el tamaño de las células, entre otros atributos. Aunque se trata de sistemas muy sensibles, los diseñadores de citómetros están sometidos a una presión constante para acelerar el tiempo de análisis, lo que exige nuevos enfoques tanto para la citometría de flujo como para su electrónica asociada.
Los citómetros someten a las células individuales a la luz láser para crear señales de dispersión y fluorescencia. Para captar con rapidez y precisión la luz resultante y convertirla en señales digitales se necesita un fotodiodo de avalancha (APD) y una compleja electrónica. El diseño y la implementación de los circuitos de este proceso pueden llevar mucho tiempo, sobre todo teniendo en cuenta que los sistemas de adquisición de datos de citometría de flujo requieren dispositivos de alta velocidad y bajo ruido para garantizar la precisión del sistema.
Para apoyar de forma rentable un análisis de citometría de flujo más rápido, los diseñadores pueden resolver los problemas de velocidad y precisión con una solución de adquisición de datos que incluya controladores de amplificación internos y un convertidor analógico-digital (ADC).
Este artículo mostrará brevemente cómo funcionan los sistemas de citometría de flujo. A continuación, presenta el ADAQ23878 de Analog Devices, un módulo ADC de 18 bits, y muestra cómo puede utilizarse para diseñar una etapa de detección y conversión de citómetro de flujo. También se presentará un kit de evaluación asociado.
Principios modernos de la citometría de flujo
La citometría de flujo moderna es un proceso automatizado que analiza las moléculas celulares y de superficie, caracteriza y define diferentes tipos de células en una población celular heterogénea. Sin contar el tiempo de preparación, que puede ser de más de una hora, el instrumento realiza una evaluación de tres a seis características de 10.000 células individuales en menos de un minuto.
Para ello, el paso de preparación de células individuales de la citometría de flujo es fundamental. La organización de las muestras se produce en una vaina de fluido hidrodinámico para concentrar las células o partículas en un flujo de muestra estrecho y de línea unicelular para su análisis. Con esta transformación, las células individuales deben mantener sus características biológicas naturales y sus componentes bioquímicos.
La figura 1 muestra un diagrama de un instrumento de citómetro de flujo que comienza en la parte superior con la muestra de células múltiples.
 Figura 1: Diagrama de un citómetro de flujo, desde el enfoque de la vaina hasta la adquisición de datos. (Fuente de la imagen: Wikipedia, modificada por Bonnie Baker)
Figura 1: Diagrama de un citómetro de flujo, desde el enfoque de la vaina hasta la adquisición de datos. (Fuente de la imagen: Wikipedia, modificada por Bonnie Baker)
Los seis componentes principales del citómetro de flujo son una célula de flujo, un láser, un fotodiodo de avalancha (APD), un amplificador de transimpedancia (TIA), un ADC y un ordenador para la recogida y el análisis de datos.
El citómetro de flujo tiene una corriente líquida o fluido de vaina, que se estrecha para llevar y alinear las células en una sola fila a través del haz de luz. La luz láser captura una célula a la vez, creando una señal de luz dispersa hacia adelante (FSC) y una señal de luz dispersa hacia los lados (SSC). La luz de fluorescencia se clasifica mediante espejos y filtros y luego se amplifica mediante un APD.
El siguiente paso es detectar, digitalizar y analizar la salida de luz resultante después de que llegue al APD. Para la detección, el amplificador óptico FET de entrada de 500 megahercios (MHz) LTC6268 de Analog Devices, de baja corriente de polarización y bajo ruido de tensión, es ideal para la TIA de alta velocidad necesaria para la detección.
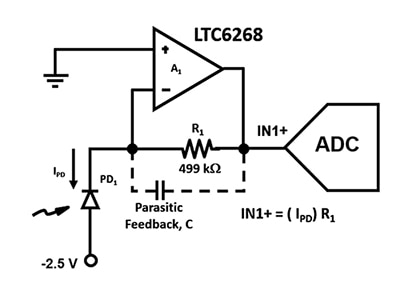 Figura 2: El circuito TIA utiliza un APD (PD1) y un amplificador operativo FET de baja corriente de entrada para convertir las corrientes ultrabajas del fotodiodo en una tensión de salida en IN1+. (Fuente de la imagen: Bonnie Baker)
Figura 2: El circuito TIA utiliza un APD (PD1) y un amplificador operativo FET de baja corriente de entrada para convertir las corrientes ultrabajas del fotodiodo en una tensión de salida en IN1+. (Fuente de la imagen: Bonnie Baker)
Es esencial diseñar este circuito amplificador con el mayor ancho de banda posible, por lo que hay que minimizar las capacitancias parásitas. Por ejemplo, la capacitancia parásita de retroalimentación, C, influye en la estabilidad y el ancho de banda del circuito de la Figura 2. Independientemente de la elección del paquete de resistencias, siempre habrá una capacitancia parásita en la ruta de retroalimentación del amplificador. Sin embargo, el encapsulado 0805, que tiene una mayor distancia entre las tapas de los extremos y la menor capacitancia parásita, es preferible para aplicaciones de alta velocidad.
Aumentar la distancia entre las tapas de los extremos de R1 no es la única forma de disminuir la capacitancia. Otra forma de reducir la capacitancia de placa a placa es apantallar las trayectorias de campo E que dan lugar a la capacitancia parásita colocando una traza de tierra adicional debajo de la resistencia, R1 (Figura 3).
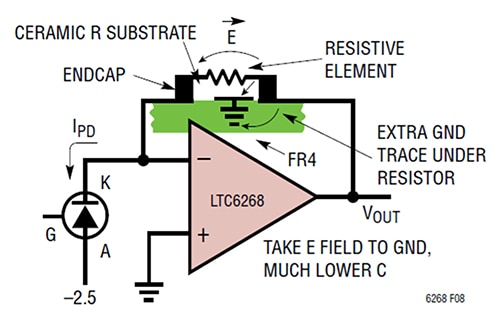 Figura 3: La adición de una traza de tierra bajo la resistencia de realimentación desvía el campo E del lado de la realimentación y lo vierte a tierra. (Fuente de la imagen: Analog Devices).
Figura 3: La adición de una traza de tierra bajo la resistencia de realimentación desvía el campo E del lado de la realimentación y lo vierte a tierra. (Fuente de la imagen: Analog Devices).
En este caso, el método consiste específicamente en colocar una traza de tierra corta por debajo y entre las almohadillas de la resistencia cerca del extremo de salida del TIA. Esta técnica proporciona un valor de capacitancia parásita de 0,028 picofaradios (pF) con un ancho de banda TIA de 1/(2π*RF*CPARASITIC), que equivale a 11.4 MHz.
Las señales de luz óptica apuntan hacia varios diodos de avalancha con filtros ópticos adecuados. El sistema APD, TIA y ADC convierten estas señales en su representación digital y envían los datos al microprocesador para su posterior análisis.
Los instrumentos modernos suelen tener varios láseres y APD. Los dispositivos comerciales actuales tienen diez láseres y treinta fotodiodos de avalancha. El aumento del número de detectores láser y fotomultiplicadores permite el etiquetado múltiple de anticuerpos para identificar con precisión las poblaciones objetivo mediante marcadores fenotípicos.
Aun así, la velocidad del análisis depende de un fino equilibrio de:
- La velocidad de la vaina del fluido
- La capacidad del proceso de enfoque hidrodinámico para formar líneas unicelulares
- El diámetro del túnel
- La capacidad de preservar la integridad de una célula
- La electrónica
Citometría de flujo con enfoque acústico
Aunque la adición de múltiples láseres y APD acelera el análisis y la identificación, en el mejor de los casos, los últimos métodos modernos de citometría de flujo unicelular pueden recoger datos de hasta un millón de células individuales por minuto. En muchas aplicaciones, como la detección de células tumorales circulantes presentes en la sangre a niveles tan bajos como 100 células por mililitro, esto es inadecuado. En las aplicaciones clínicas de las células raras, las pruebas suelen requerir el análisis de miles de millones de células, que requiere mucho tiempo.
La alternativa al proceso de preparación de células con enfoque hidrodinámico es un proceso de enfoque acústico. Aquí, un material piezoeléctrico, como el titanato de circonato de plomo (PZT), se une a un capilar de vidrio para convertir los pulsos eléctricos en vibraciones mecánicas (Figura 4a). Utilizando un PZT para hacer vibrar las paredes laterales de un capilar de vidrio a la frecuencia de resonancia de la célula de flujo rectangular, el sistema genera una variedad de ondas acústicas estacionarias con un número variable de nodos de presión.
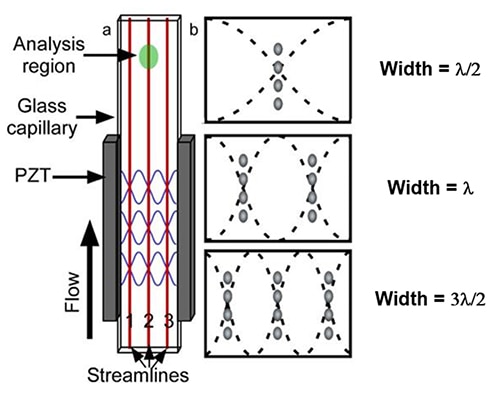 Figura 4: Ilustración de una célula de flujo acústico realizada con un capilar de vidrio rectangular (a). La ubicación de los tres primeros nodos de presión para un capilar de ancho fijo (b). (Fuente de la imagen: National Center for Biotechnology Information)
Figura 4: Ilustración de una célula de flujo acústico realizada con un capilar de vidrio rectangular (a). La ubicación de los tres primeros nodos de presión para un capilar de ancho fijo (b). (Fuente de la imagen: National Center for Biotechnology Information)
Estos nodos de frecuencia PZT alinean las partículas que fluyen en líneas de flujo múltiples y discretas (Figura 4b). La célula de flujo acústico utiliza una onda acústica lineal y estacionaria para sintonizar varias longitudes de onda mediante la creación de armónicos simples o múltiples. Como predice el modelo de onda estacionaria lineal simple, las células de la muestra producen líneas unicelulares o numerosas dentro de la cámara de flujo.
Con esta organización precisa de las células, la anchura del túnel de la vaina de flujo puede ampliarse para permitir velocidades de flujo más rápidas más allá del rayo láser (Figura 5).
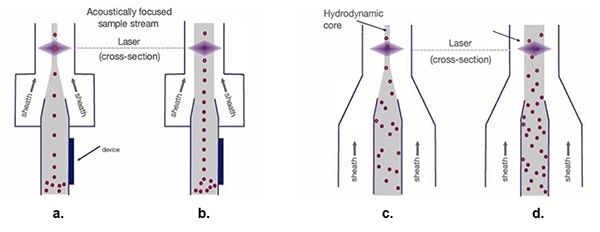 Figura 5: Con la corriente de muestra hidrodinámica (c. y d.), a medida que aumenta el ancho de la vaina, las muestras de células se dispersan, lo que dificulta el proceso de medición óptica. Flujos de muestras enfocados acústicamente (a. y b.) mantener las células de una sola fila independientemente de la anchura de la vaina. (Fuente de la imagen: Thermo Fischer Scientific)
Figura 5: Con la corriente de muestra hidrodinámica (c. y d.), a medida que aumenta el ancho de la vaina, las muestras de células se dispersan, lo que dificulta el proceso de medición óptica. Flujos de muestras enfocados acústicamente (a. y b.) mantener las células de una sola fila independientemente de la anchura de la vaina. (Fuente de la imagen: Thermo Fischer Scientific)
El enfoque hidrodinámico tradicional (Figura 5c.) organiza las líneas de células individuales en preparación para el escaneo láser. Si bien un embudo más ancho para el núcleo de la corriente de muestra permite una mayor velocidad del material de la vaina (Figura 5d.), también da lugar a la dispersión de la organización unicelular, produciendo una variación de la señal y una calidad de datos comprometida.
El enfoque acústico (Figura 5a.) posiciona las células biológicas y otras partículas en una alineación estrecha, incluso con un túnel más amplio. Esta alineación precisa de las células permite una mayor velocidad de muestreo manteniendo la calidad de los datos (Figura 5b.).
En la práctica, el enfoque acústico de la citometría de flujo aumenta la frecuencia de muestreo de células en ~20x (Figura 6).
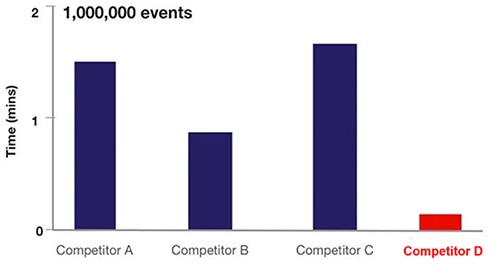 Figura 6: Comparación del tiempo de muestreo para varios equipos de citometría de flujo basados en la citometría de flujo de fluidos (A, B, C) frente a la citometría de enfoque acústico (D). (Fuente de la imagen: Thermo Fischer Scientific)
Figura 6: Comparación del tiempo de muestreo para varios equipos de citometría de flujo basados en la citometría de flujo de fluidos (A, B, C) frente a la citometría de enfoque acústico (D). (Fuente de la imagen: Thermo Fischer Scientific)
En la Figura 6, los equipos de A, B y C utilizan tecnología hidrodinámica, mientras que D utiliza el enfoque de flujo de citometría de enfoque acústico.
Adquisición de datos de citometría de flujo con enfoque acústico
El diseño de la electrónica del equipo de citometría de flujo con enfoque acústico requiere una electrónica de fotodetección de alta velocidad para adaptarse a la velocidad de las células sanguíneas y del fluido de la vaina a través de la boquilla de mayor diámetro. El LTC6268 de alta velocidad de 600 MHz mencionado anteriormente, en combinación con un diseño de paquete de resistencia 0805 especializado, lleva la velocidad de detección óptica hasta 11,4 MHz (Figura 7, izquierda). La salida del LTC6268 se envía a un ADC ADAQ23878 de Analog Devices para su digitalización.
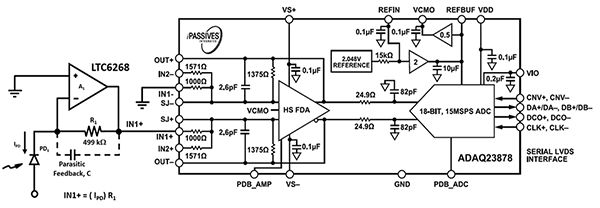 Figura 7: El ADC ADAQ23878 digitaliza la señal óptica del fotodiodo (PD1) y del circuito TIA (izquierda). (Fuente de la imagen: Bonnie Baker)
Figura 7: El ADC ADAQ23878 digitaliza la señal óptica del fotodiodo (PD1) y del circuito TIA (izquierda). (Fuente de la imagen: Bonnie Baker)
El ADAQ23878 es una solución de adquisición de datos de alta velocidad, de 18 bits y 15 megamuestras por segundo (MSPS). Reduce en gran medida el ciclo de desarrollo de los sistemas de medición de precisión al transferir la carga de diseño de la selección de componentes del controlador de entrada, la optimización y el diseño del diseñador al dispositivo.
El enfoque modular del SIP reduce el número de componentes del sistema final al combinar múltiples bloques de procesamiento y acondicionamiento de señales comunes en un único dispositivo, junto con el ADC de alta velocidad de 18 bits y 15 MSPS de registro de aproximación sucesiva (SAR). Estos bloques incluyen un amplificador conductor de ADC de bajo ruido y totalmente diferencial, y un búfer de referencia estable.
El ADAQ23878 también incorpora los componentes pasivos críticos que utilizan la tecnología iPassive de Analog Devices para minimizar las fuentes de error dependientes de la temperatura y optimizar el rendimiento. La etapa de controlador de asentamiento rápido del ADC contribuye a su capacidad para garantizar una rápida adquisición de datos.
Evaluación del µmódulo ADAQ23878
Para evaluar el ADAQ23878, Analog Devices proporciona la placa de evaluación EVAL-ADAQ23878FMCZ (Figura 8). La placa demuestra el rendimiento del μModule ADAQ23878 y es una herramienta versátil para evaluar un diseño de front-end de citometría de flujo, y una variedad de otras aplicaciones.
 Figura 8: La placa de evaluación EVAL-ADAQ23878FMCZ para el ADAQ23878 tiene circuitos de alimentación integrados, viene con el software asociado para el control y el análisis de datos, y es compatible con SDP-H1. (Fuente de la imagen: Analog Devices).
Figura 8: La placa de evaluación EVAL-ADAQ23878FMCZ para el ADAQ23878 tiene circuitos de alimentación integrados, viene con el software asociado para el control y el análisis de datos, y es compatible con SDP-H1. (Fuente de la imagen: Analog Devices).
La placa de evaluación EVAL-ADAQ23878FMCZ requiere una computadora personal con Windows 10 o superior, una fuente de señal de precisión de bajo ruido y un filtro pasabanda adecuado para pruebas de 18 bits. La placa de evaluación necesita el complemento ADAQ23878 ACE y el controlador SPD-H1.
Conclusión:
El examen de una célula biológica a la vez mediante técnicas estándar de citometría de flujo de enfoque hidrodinámico ha tenido éxito, pero con la necesidad de un análisis más rápido, se ha producido un cambio hacia técnicas basadas en métodos de flujo de enfoque acústico. Sin embargo, la electrónica que soporta la citometría de flujo más avanzada también debe mejorar, minimizando el espacio, el costo y el tiempo de desarrollo.
Como se muestra, el amplificador operacional de alta velocidad LTC6268 y la solución de adquisición de datos de precisión y alta velocidad μModule ADAQ233878 pueden combinarse para crear el sistema completo de adquisición de datos para equipos avanzados de citometría de flujo.

Descargo de responsabilidad: Las opiniones, creencias y puntos de vista expresados por los autores o participantes del foro de este sitio web no reflejan necesariamente las opiniones, las creencias y los puntos de vista de DigiKey o de las políticas oficiales de DigiKey.







